
07 May 2020
Tempi e costi per lo sviluppo di un farmaco o di un vaccino
Come nasce un farmaco?
Quali sono i tempi di sviluppo di un farmaco?
In cosa consistono i Clinical Trial?
Scopriamo insieme i processi e le diverse fasi di sviluppo di un nuovo farmaco.
Lo sviluppo di un farmaco è un processo molto lungo, costoso e rischioso per gli investitori.
Quasi tutti gli studi di settore concordano sul fatto che tale processo impegni circa un decennio di ricerche e assorba oltre 1,5 miliardi di dollari per introdurre sul mercato un farmaco approvato dall’EMA (European Medicines Agency) o dall’FDA (U.S. Food and Drug Administration).
Queste stime, inoltre, non tengono in considerazione le spese sostenute dalle imprese per numerosi farmaci il cui sviluppo viene interrotto prima di raggiungere il mercato.
Nel settore farmaceutico solo uno ogni 5000 composti testati riesce ad arrivare nelle farmacie e solo 1/3 di questi conquisterà fette di mercato tali da ripagare l’investimento necessario per svilupparlo.
Uno studio pubblicato da Forbes nel 2013 ha rivelato che, confrontando le spese complessive di R&S con le approvazioni di nuovi farmaci, le farmaceutiche spendano in realtà oltre 6 miliardi di dollari per ciascun farmaco approvato.
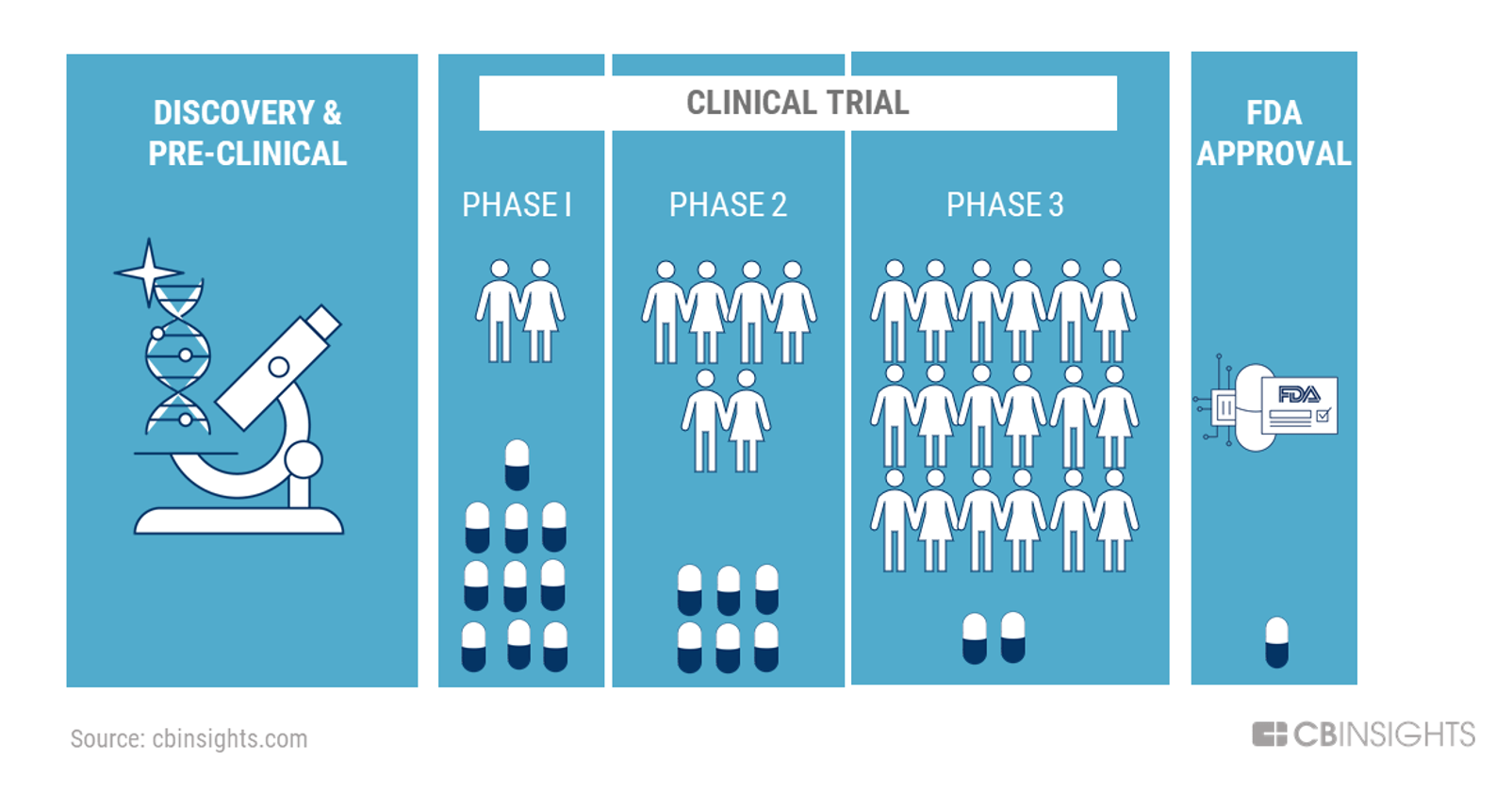
I CLINICAL TRIAL
Il costo principale nel processo di sviluppo di un farmaco è, nella maggior parte dei casi, quello relativo ai trial clinici.
Ad esempio, per ottenere l’approvazione da parte della FDA negli Stati Uniti la maggior parte dei farmaci deve superare una serie di fasi, i trial appunto.
STUDI PRECLINICI
Per prima cosa, durante gli studi preclinici, l’impresa “sponsor” dello sviluppo del farmaco è chiamata a valutarne la sicurezza e l’efficacia attraverso la sperimentazione in vitro e in vivo (sugli animali).
I test in vitro sono prove su cellule o porzioni di cellule sia animali che umane. Queste cellule coltivate in laboratorio (cioè fatte crescere in un ambiente che riproduce le dinamiche del corpo umano) si comportano quasi come un organismo vivente in piccolo e possono fornire molte risposte.
Una volta che gli studi sulle cellule hanno dato risultati incoraggianti, si prosegue provando il farmaco in vivo sugli animali. Gli animali più usati sono i topi. In parte minore si utilizzano cani, gatti, criceti, conigli, anfibi e ancora più raramente (anche perché sono studi molto costosi) primati, come le scimmie.
Ormai da tempo, anche per le continue proteste dei gruppi animalisti, gli scienziati sono diventati molto sensibili sull’utilizzo di animali per la ricerca.
Alcuni esami molto dolorosi sono stati rimpiazzati da test su cellule di tessuti umani e, quando non è possibile fare altrimenti, si cerca di usare un piccolo numero di animali, provocando il minore grado di sofferenza possibile.
FASE ZERO
Nella fase zero una singola dose del farmaco – inferiore a quella necessaria per fornire il trattamento terapeutico – è somministrata a un piccolo gruppo di soggetti sani (10-15) per valutare l’effetto e la tollerabilità del farmaco sull’organismo.
FASE 1
In questa fase della sperimentazione clinica, il farmaco è somministrato ad un gruppo più esteso di soggetti sani (20-80) per dare una prima valutazione della sicurezza del farmaco, determinarne i dosaggi e identificarne gli effetti collaterali. Se lo studio del farmaco rigurda gravi patologie, le sperimentazioni in fase 1 possono essere condotte direttamente su soggetti affetti dalla patologia per cui il farmaco e stato concepito.
FASE 2
Una volta dimostrato che i livelli di tossicità del farmaco sono accettabili relativamente al beneficio atteso, si passa al trial di fase 2, in cui il farmaco è somministrato ad un gruppo ancora maggiore di individui (100-300), tutti affetti da patologie per cui il farmaco è stato pensato, per indagarne meglio l’efficacia terapeutica.
FASE 3
Nella fase 3 del trial clinico, la sostanza medicinale viene somministrata a 1000-3000 soggetti per confermare efficiacia terapeutica, comparandola ad i farmaci già in commercio e si monitorano gli effetti di lungo periodo sui pazienti.
In questa fase i tester non sanno se hanno ricevuto il nuovo trattamento o uno tradizionale.
Se il farmaco supera tutte le prove di sperimentazione clinica di fase 3, i dati vengono raccolti in un dossier che viene sottoposto all’autorità di regolamentazione del mercato (AIFA in Italia) per richiedere l’approvazione del nuovo farmaco e l’autorizzazione alla commercializzazione.
L’intero processo, solitamente, copre un arco temporale di 10-12 anni e costa centinaia di milioni di euro.

